 了解卵母细胞成熟的机制对于生殖生物学和医学来说是必不可少的。从生发囊泡(GV)阶段开始直到早期胚胎的合子激活,卵母细胞降低其全基因组转录活性,依靠翻译调控来控制基因表达。近年来的单细胞多组学和干细胞体外分化研究为揭示人类卵母细胞基因表达开辟了新的途径。然而,受限于目前质谱蛋白质组学的局限性,这些研究主要集中在基因的转录表达水平,并不能真实地反应卵子成熟过程中的翻译表达水平或蛋白表达水平。2022年8月30,清华大学医学院纪家葵课题组、中山大学附属第六医院生殖中心梁晓燕课题组及国内多家生殖中心团队合作,以“Single-cell transcriptome and translatome dual-omics reveals potential mechanisms of human oocyte maturation”为题在线发表于Nature communications,该研究团队开发出的适用于单个卵母细胞且不需要任何纯化标签的转录-翻译双组学测序技术(T&T-seq),可同时检测单个卵母细胞样本中的总mRNA及正在翻译的mRNA,并以此揭示了小鼠和人卵母细胞之间不同的翻译表达模式,描述了人类卵母细胞成熟过程中从细胞质到细胞核的序列基因表达调控。此外,该研究发现OOSP2分泌蛋白对卵子的体外成熟具有促进作用,为临床辅助生殖技术提供新的技术手段。
了解卵母细胞成熟的机制对于生殖生物学和医学来说是必不可少的。从生发囊泡(GV)阶段开始直到早期胚胎的合子激活,卵母细胞降低其全基因组转录活性,依靠翻译调控来控制基因表达。近年来的单细胞多组学和干细胞体外分化研究为揭示人类卵母细胞基因表达开辟了新的途径。然而,受限于目前质谱蛋白质组学的局限性,这些研究主要集中在基因的转录表达水平,并不能真实地反应卵子成熟过程中的翻译表达水平或蛋白表达水平。2022年8月30,清华大学医学院纪家葵课题组、中山大学附属第六医院生殖中心梁晓燕课题组及国内多家生殖中心团队合作,以“Single-cell transcriptome and translatome dual-omics reveals potential mechanisms of human oocyte maturation”为题在线发表于Nature communications,该研究团队开发出的适用于单个卵母细胞且不需要任何纯化标签的转录-翻译双组学测序技术(T&T-seq),可同时检测单个卵母细胞样本中的总mRNA及正在翻译的mRNA,并以此揭示了小鼠和人卵母细胞之间不同的翻译表达模式,描述了人类卵母细胞成熟过程中从细胞质到细胞核的序列基因表达调控。此外,该研究发现OOSP2分泌蛋白对卵子的体外成熟具有促进作用,为临床辅助生殖技术提供新的技术手段。
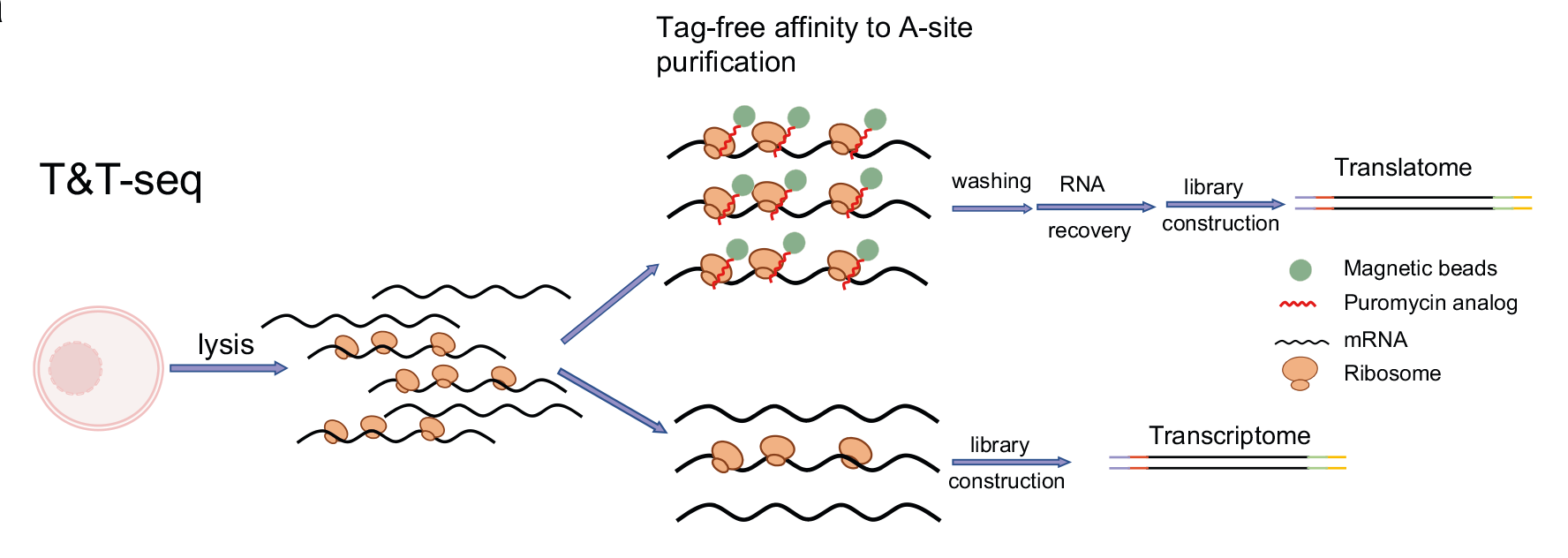
图1 T&T-seq原理示意图
研究材料人GV卵母细胞、MII卵母细胞、桑葚胚;小鼠GV卵母细胞、MII卵母细胞技术路线- 描绘人类卵母细胞成熟过程中的转录组和翻译组图谱;
- 探究高翻译的基因共有的翻译调节元件;
- 探究人类与小鼠卵母细胞的独特翻译基因;
- 探究OOSP2蛋白对卵母细胞成熟的调控作用;
主要研究结果- 描绘人类卵母细胞成熟过程中的转录组和翻译组图谱
研究人员通过T&T-seq对10个、单个人卵母细胞及桑葚胚进行实验,共得到11756个GV和10559个MII翻译基因,并将获得的翻译组学数据与先前文献报道中使用100个人类GV或MII卵母细胞的蛋白质组学数据进行比较,结果显示超过86%的GV蛋白和83%的MII蛋白被检测到(图2a)。此外,作者对转录组和翻译组的数据进行PCA聚类分析。结果发现转录组的 PCA 中GV和MII卵母细胞有部分重叠,而相同样本的翻译组PCA结果明显地分离了 GV 卵母细胞、MII 卵母细胞和胚胎,这表明翻译组要比转录组更能够表现GV和MII卵母细胞之间的差异(图2b)。进一步地,研究者在转录组和翻译组水平上分析了GV和MII卵母细胞中的差异表达基因,结果显示在卵母细胞成熟过程中,大多数基因的转录水平保持不变或降低。此外,在成熟的卵母细胞中,基因的翻译效率要高于未成熟的卵子。值得注意的是,大多数GV富集的基因参与细胞质过程,而MII富集的基因主要参与细胞核或染色体过程(图2 h-j),这一结果揭示了卵母细胞成熟过程中基因表达从细胞质到细胞核的顺序调节。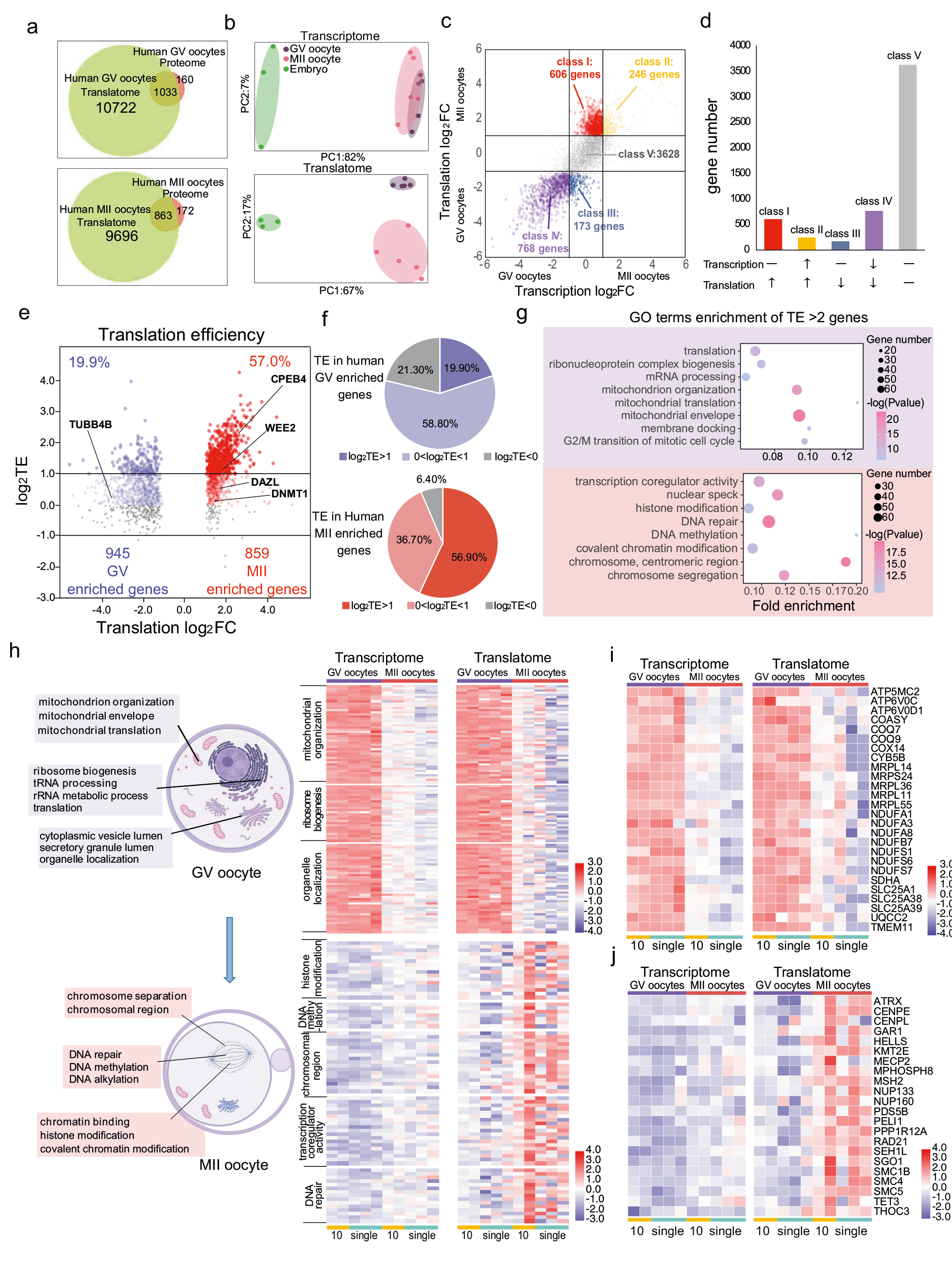
图2 GV和MII人类卵母细胞的不同转录组和翻译组表达情况
2. 探究高翻译的基因共有的翻译调节元件
先前对小鼠的研究表明,卵母细胞成熟过程中的高翻译表达是由RNA结合蛋白(RBP)与3'UTR结合的翻译调节元件所调节。然而,由于缺乏翻译组数据集,目前尚未报道人类卵母细胞中的RBP基序。因此,研究者筛选了人类GV和MII卵母细胞中高翻译效率[ TE(>1)] 基因的3' UTR,以确定潜在的RBP位点,并研究RBP作为潜在的翻译调控因子。研究人员筛选出了高TE MII基因中的RBP结合基序,分别为FXR1、PCBP1、DDX3X、CPEB2和CPEB4 的结合基序。此外,研究者鉴定出与卵母细胞成熟相关的GO聚类中的高 TE基因,例如“染色体分离”、“减数分裂细胞周期”和“甲基化”等。
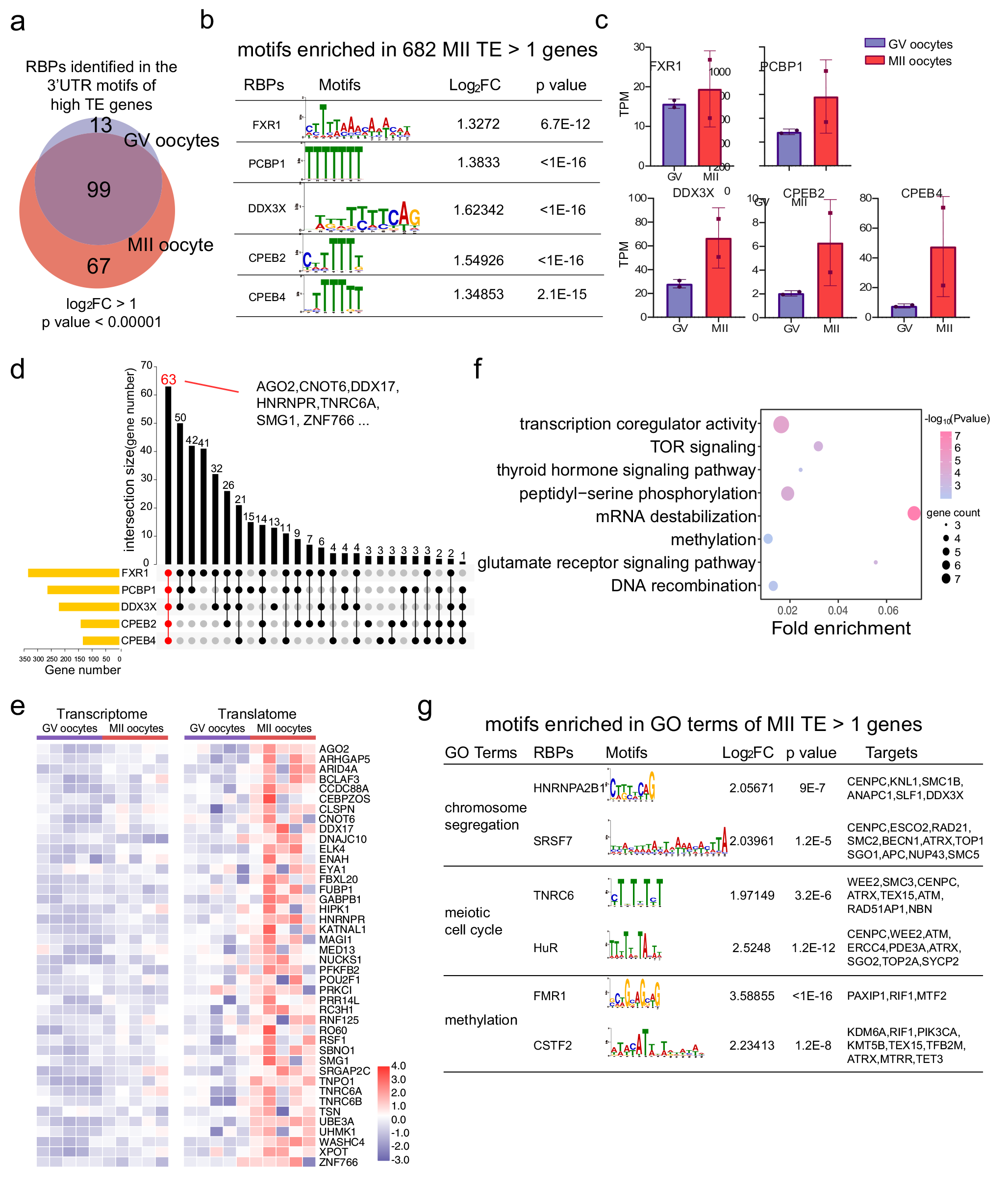
图3 高翻译基因3‘UTR富集出的RBP结合基序
3. 探究人类与小鼠卵母细胞的独特翻译基因
小鼠模型常被用于研究和推断人类卵母细胞成熟的机制,然而,人类卵母细胞可能存在独特的翻译表达和调控。因此,基于小鼠和人类卵母细胞的T&T-seq,研究者通过选择人类卵母细胞中翻译水平较高但在小鼠卵母细胞中翻译相对较低的DEGs,分析了独特的人类DEGs。结果发现了247个GV特异性基因和259个MII特异性基因,在这些独特的人类MII基因中,DNMT1、MSH3、CENPK、OOSP2和AGO2在人类和小鼠中的翻译表达趋势相反(图4f)。值得注意的是,在小鼠OOSP家族中,OOSP1和OOSP3蛋白都是在成熟过程中表达上调的,而OOSP2蛋白是在成熟过程中表达下调。然而在人的OOSP家族中却正好相反。研究者发现小鼠OOSP2基因只有一个PAS基序,而OOSP1和OOSP3均有多个与PAS基序相邻的CPE基序。相比之下,人类OOSP2是同时携带CPE和PAS的OOSP基因(图4)。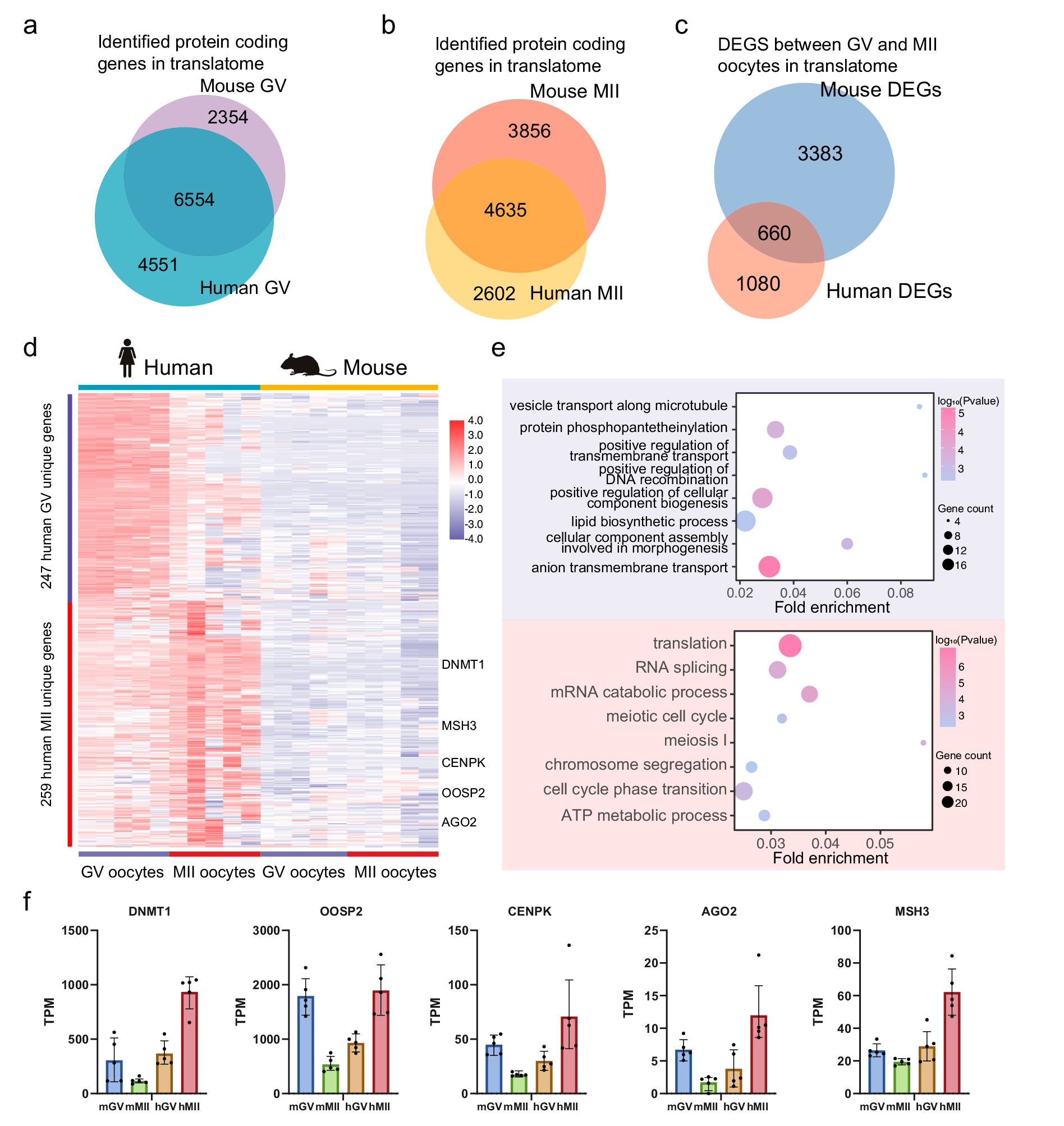
图4人与小鼠卵母细胞的翻译组差异
4. OOSP2蛋白诱导卵母细胞成熟
PPI分析显示,OOSP2可能参与卵泡产生及卵母细胞成熟。为了探究OOSP2是否对卵子的成熟具有调控作用,研究者收集了GV卵母细胞,并使用带有延时显微镜的孵化器来监测卵母细胞的成熟。结果表明,添加OOSP2蛋白可以提高人卵母细胞体外成熟率,而添加OOSP2的抗体则会阻断OOSP2蛋白的功能,从而影响卵母细胞的成熟(图5)。此外,研究者进一步探究了OOSP2的潜在诱导基因或途径。通过检测与hReco-OOSP2、α-OOSP2或无任何添加剂共孵育1.5 h的人类GV卵母细胞的转录组和翻译组,结果表明α-OOSP2处理的GV卵母细胞保持不成熟状态,而hReco-OOSP2处理的GV卵母细胞更接近于成熟卵子。另外,OOSP2可以直接调控下游基因的翻译,并通过上调特定的信号通路,如小GTPase信号通路、细胞器定位通路等,来促进卵母细胞的核质成熟(图6)。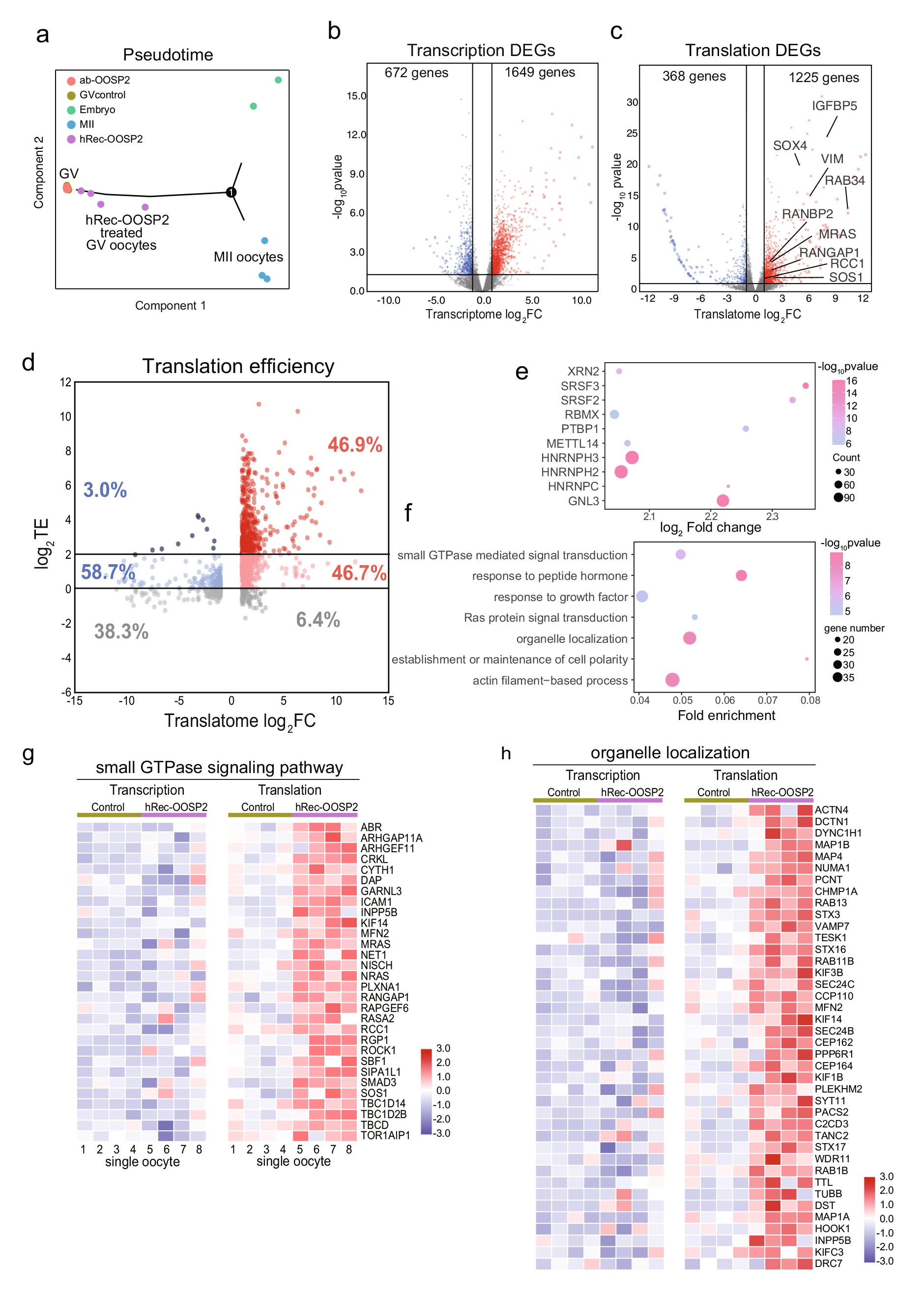
图5 OOSP2促进人卵母细胞体外成熟
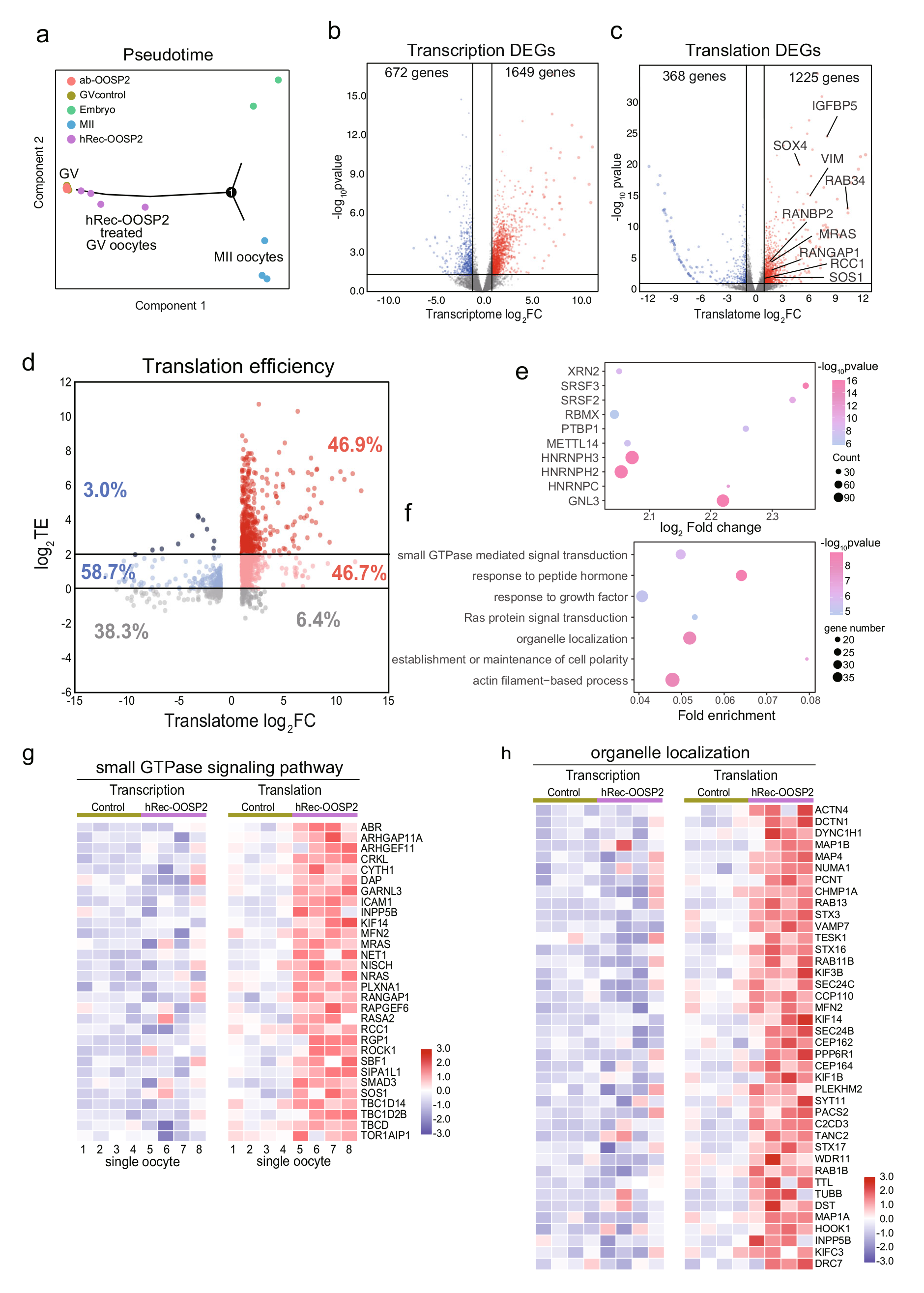
图6 T&T-seq揭示OOSP2处理人类卵母细胞后的转录组和翻译组变化
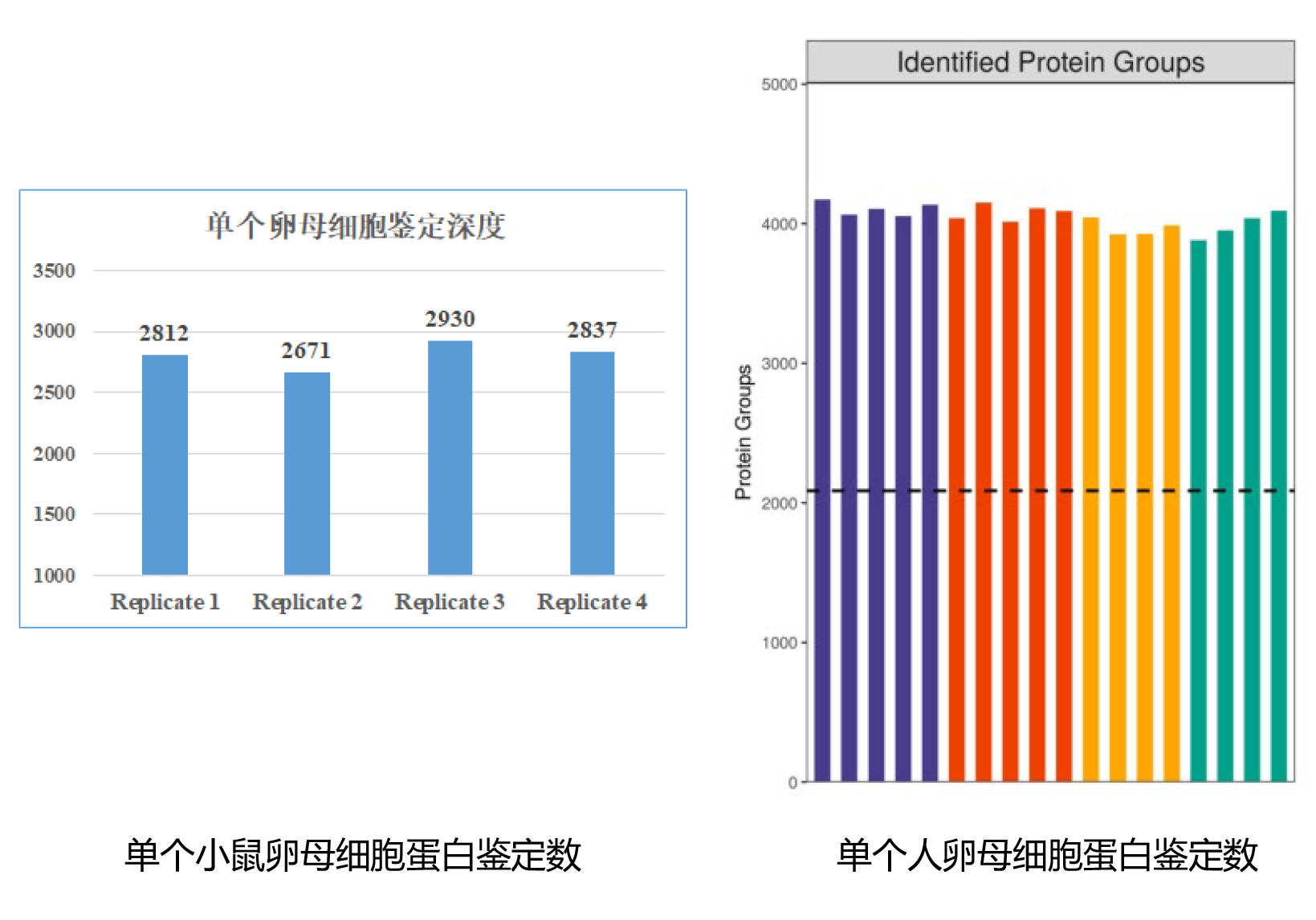
小结:研究者通过适用于单个卵母细胞的T&T-seq技术,揭示了人卵母细胞成熟过程中从细胞质到细胞核的时空顺序调节; 发现了小鼠和人类的卵母细胞在成熟过程中翻译的差异化;鉴定出OOSP2分泌蛋白可能通过调控小GTPase信号通路相关蛋白的翻译来促进卵母细胞成熟,为临床卵母细胞体外成熟技术提供了新的技术方法及理论依据。文章中所用的是单细胞翻译组,而中科新生命自建立单细胞蛋白质组学技术平台以来,已经在检测数量,检测深度上实现重大突破。针对卵母细胞、受精卵、胚胎等生殖领域样本,中科新生命已可在单个细胞层面实现高深度的蛋白鉴定,如单个小鼠卵母细胞平均2800+蛋白鉴定数,单个人卵母细胞平均4000+蛋白鉴定数。
 好消息好消息!为了回馈广大科研工作者的大力支持,中科新生命特别推出优惠活动,即日起至11月30日,只要买单细胞蛋白就送单细胞测序,买一赠一!(单细胞蛋白组学满600个细胞起赠单细胞测序)除此以外,还有更多的蛋白组学产品及多组学优惠等着您,欢迎留言或致电咨询~
好消息好消息!为了回馈广大科研工作者的大力支持,中科新生命特别推出优惠活动,即日起至11月30日,只要买单细胞蛋白就送单细胞测序,买一赠一!(单细胞蛋白组学满600个细胞起赠单细胞测序)除此以外,还有更多的蛋白组学产品及多组学优惠等着您,欢迎留言或致电咨询~









