嵌合抗原受体(CAR)T细胞疗法在治疗血液系统恶性肿瘤方面目前已经取得了显著成功,但其在实体瘤治疗中仍面临三大核心障碍:肿瘤特异性抗原缺失、T细胞归巢与浸润能力不足以及免疫抑制性的肿瘤微环境(TME)。为突破这些局限,科学界正积极探索多种联合策略,其中,将CAR-T细胞疗法与免疫检查点抑制剂、放疗或溶瘤病毒联合使用,已被证实有改善临床疗效的潜力。
作为一种理想的联合治疗药物,溶瘤病毒是一种能选择性感染并裂解癌细胞的病毒。其作用机制不仅在于直接溶瘤,更在于能诱导肿瘤细胞发生免疫原性细胞死亡,释放信号,从而将“冷”肿瘤转化为免疫细胞富集的“热”肿瘤。此外,经过基因工程改造、可表达细胞因子或趋化因子(如CXCL9、CXCL11)的溶瘤病毒,能进一步重塑TME,增强免疫细胞浸润,与CAR-T疗法产生强大的协同效应。因此,溶瘤病毒被视为增强CAR-T实体瘤疗法的理想辅助手段。
这一思路在最新研究中得到了有力印证。2025年7月发表于期刊《Journal for ImmunoTherapy of Cancer》的一项研究《hCCL19-expressing recombinant Newcastle disease virus boosts CAR T cell infiltration and efficacy in solid tumor》阐明,一种表达人CCL19的重组新城疫病毒(rNDV19)与CAR-T细胞的联合疗法,能通过增强免疫细胞浸润与活化,有效克服实体瘤治疗瓶颈,为将“冷”肿瘤转化为“热”肿瘤提供了切实可行的新策略。

该研究基于新城疫病毒Italien株(iNDV)构建了表达人CCL19的重组病毒rNDV19。该病毒保留天然溶瘤活性,并能分泌CCL19趋化因子。研究团队将其与多西环素诱导的CD147-CAR-T细胞联用,旨在利用CCL19介导的趋化作用招募CCR7+ T细胞(包括中央记忆T细胞和干细胞记忆T细胞)浸润肿瘤。通过原位肺癌模型证实,rNDV19可通过调控肿瘤微环境增强CAR-T细胞的募集与活化,为克服实体瘤中CAR-T细胞浸润不足的难题提供了新型联合治疗策略。
rNDV19表达hCCL19并保持肿瘤选择性的溶瘤特性
研究者将rNDV19经过工程化改造,将hCCL19基因插入HN和F基因之间,并通过测序验证(图1a)。为评估插入的基因是否影响病毒复制,同时比较了rNDV19感染或iNDV感染的细胞上清液中的病毒滴度。结果显示,rNDV19的复制能力与iNDV相当(图1b)。
为评估rNDV19的肿瘤选择性细胞毒性,研究者测量了NCI-H460(肿瘤细胞)、BEAS-2B(正常细胞)和来自三名健康供体的PBMCs的活力。在NCI-H460细胞中,与PBS相比,iNDV和rNDV19在感染后72小时均显著降低细胞活力,两种病毒之间无差异。在正常细胞(BEAS-2B和PBMCs)中,iNDV和rNDV19均不影响细胞活力(图1c),证实rNDV19保留了与野生株相同的肿瘤选择性细胞毒性。

图1(a-c).表达人CCL19的重组新城疫病毒的构建与特性研究
rNDV19表达的hCCL19在体外吸引淋巴细胞
研究证实,rNDV19感染的肿瘤细胞能成功表达并分泌hCCL19蛋白,且其表达水平随时间推移而增加。通过趋化迁移实验进一步验证了其生物学功能,结果显示,rNDV19产生的hCCL19能有效吸引免疫细胞发生迁移。机制研究表明,这一趋化作用是通过hCCL19与其受体CCR7的特异性结合所介导的(图1d-f)。尤为关键的是,对CAR-T细胞亚群的分析显示(图1 f),其中有相当一部分细胞表达CCR7受体,这些细胞亚群通常与更好的治疗预后相关。该发现从机制上解释了rNDV19如何作为“增强剂”,利用其表达的hCCL19主动招募CAR-T细胞向肿瘤部位浸润,从而有望解决CAR-T疗法在实体瘤中浸润不足的问题。
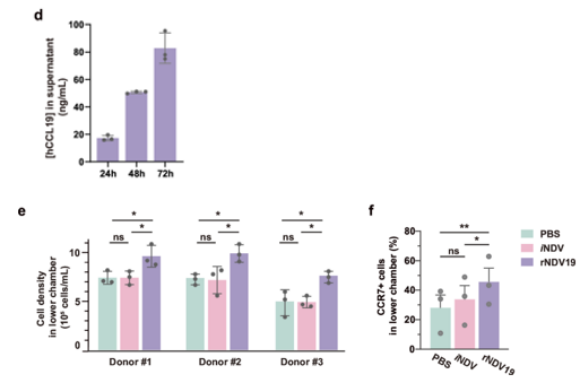
图1(d-f).表达人CCL19的重组新城疫病毒的构建与特性研究
rNDV19在体内促进CAR-T细胞的持续浸润
为探究rNDV19能否增强CAR-T细胞的肿瘤浸润,研究者在原位肺癌小鼠模型中评估了不同治疗策略的效果(图2a)。结果显示,rNDV19在肿瘤组织中的复制动力学与亲本病毒iNDV相似,并成功介导了hCCL19的表达,证实其兼具溶瘤与递送趋化因子的双重功能(图2b, c)。
在验证此基础后,进一步的分析表明,与CAR-T细胞联合使用时,rNDV19治疗组在后期表现出显著的肿瘤面积缩小,其效果优于其他对照组,展现了强大的抗肿瘤疗效(图2d, e)。
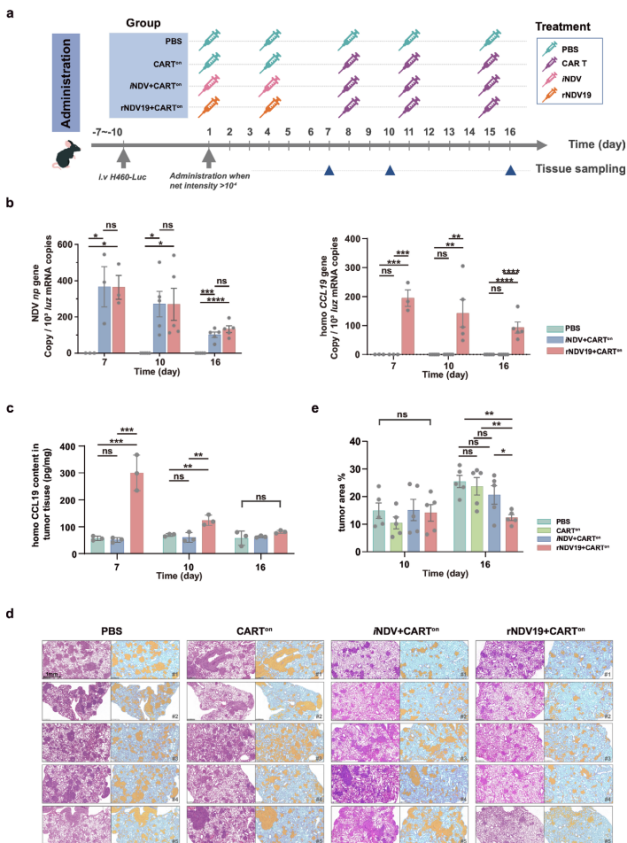
图2.rNDV19在肿瘤组织中有效复制,并与CAR-T细胞协同降低肿瘤负荷
rNDV19与CAR-T细胞联合疗法增强抗肿瘤免疫应答的转录组特征
转录组分析表明,rNDV19与CAR-T细胞联合治疗可诱导独特的抗肿瘤免疫特征。与对照组相比,联合治疗组差异表达基因数量显著增加且呈现独特转录谱(图3a,b)。功能富集分析显示该疗法特异性激活T细胞活化、白细胞趋化及细胞因子产生等关键免疫通路(图3b)。进一步分析证实联合治疗可促进CD4+ T细胞、CD8+ T细胞及树突状细胞等多类免疫细胞在肿瘤微环境中富集(图3c),并通过调节趋化因子信号通路增强免疫细胞迁移能力。这些证据共同表明rNDV19能有效激活肿瘤免疫微环境,提升CAR-T细胞治疗效果。
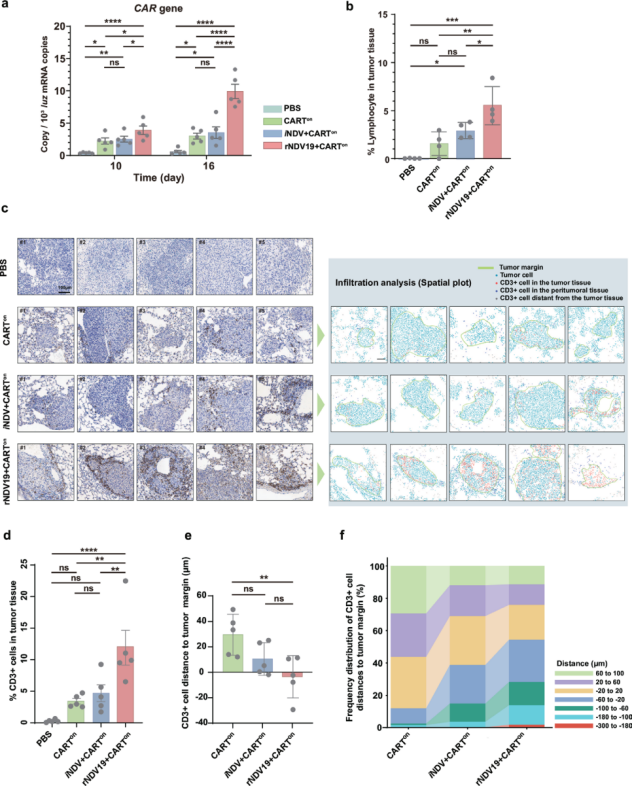
图3.rNDV19与CAR-T细胞联合疗法增强抗肿瘤免疫应答的转录组特征
rNDV19与CAR-T细胞联合疗法的协同抗肿瘤效应
本研究通过系统评估rNDV19与CAR-T细胞联合治疗在原位肺癌模型中的疗效,证实该联合策略能显著提升治疗效果。研究人员将荷瘤小鼠分为六个治疗组(含对照组、单药组及联合治疗组)。生存分析显示,联合治疗组小鼠生存期显著延长,死亡风险明显降低(图4a, 4b)。相较于单药治疗,联合治疗组展现出显著生存优势。通过设立CAR-T细胞失活对照组,证实疗效依赖活性CAR-T细胞的特异性作用(图4c)。生物发光成像显示联合治疗能有效抑制肿瘤进展(图4d),同时减轻治疗相关的体重下降等副作用(图4e)。该研究证实rNDV19能通过协同作用增强CAR-T细胞的抗肿瘤效能,在延长生存期、控制肿瘤负荷及改善治疗耐受性方面展现出显著优势,为临床转化提供重要依据。
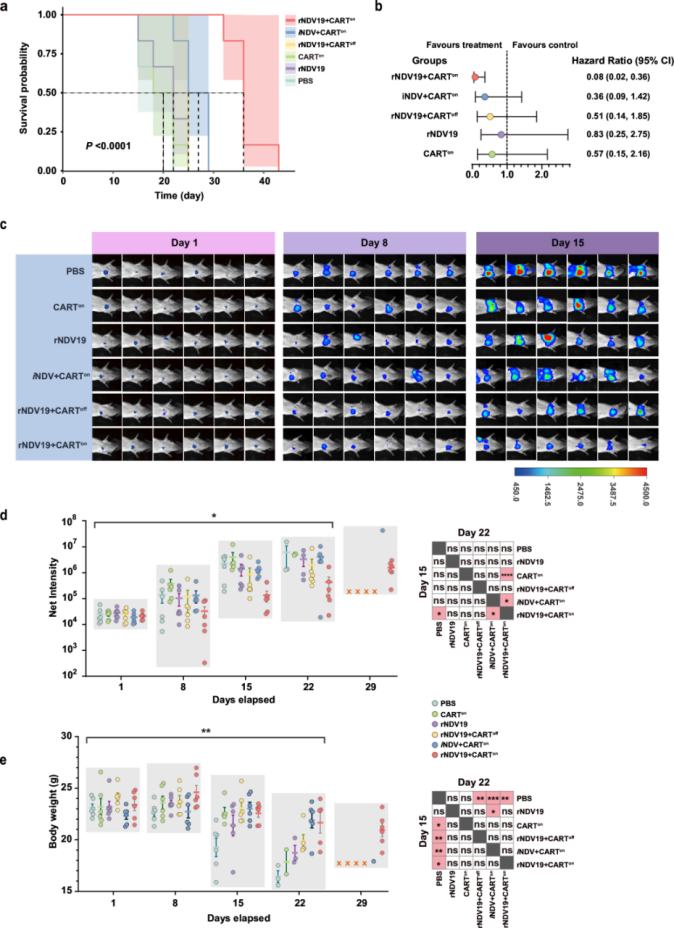
图4.rNDV19与CAR-T细胞的联合治疗显著延长了荷瘤小鼠的生存期
该研究首次证实,表达hCCL19的重组新城疫病毒(rNDV19)可通过系统性给药与CAR-T细胞协同作用,显著增强免疫细胞在原位肺癌模型中的浸润深度与活性。转录组分析显示联合治疗特异性激活T细胞趋化与分化关键通路,促使免疫微环境由"冷"转"热"。生存研究证实该策略能显著延长荷瘤小鼠生存期并降低肿瘤负荷,其疗效依赖于活性CAR-T细胞的功能协同,为溶瘤病毒与细胞免疫联合治疗实体瘤提供了创新性解决方案。
上述前沿基础研究成功将溶瘤病毒联合疗法推向新的高度,而其从实验室概念到临床转化,离不开成熟的工艺平台与系统的临床前研发支持。迪福润丝生物正是依托其全球领先的重组病毒载体技术平台,为此类创新疗法的开发提供全流程CRO解决方案。
迪福润丝生物溶瘤病毒候选株构建服务
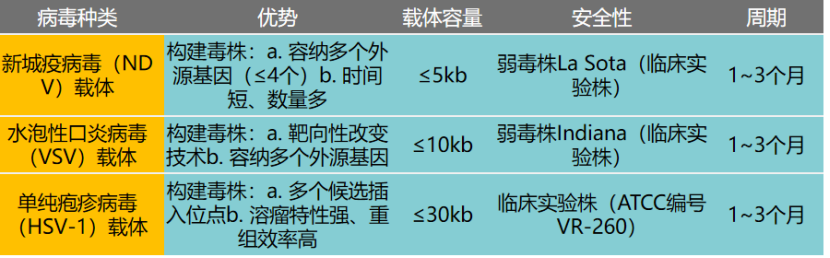
迪福润丝生物在溶瘤病毒药物的临床前研究方面具备系统化平台能力。公司通过对病毒株基因组进行改造,以提升溶瘤病毒的抗肿瘤活性。目前,公司可改造的溶瘤病毒载体涵盖新城疫病毒(NDV)、水疱性口炎病毒(VSV)、单纯疱疹病毒(HSV-1)等,已建立起多种类型的小鼠肿瘤模型,可为不同肿瘤提供系统性的溶瘤病毒有效性评价服务。
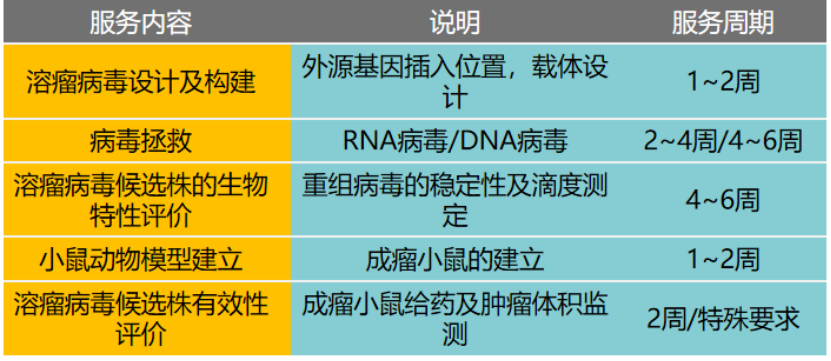
服务内容:
服务案例:
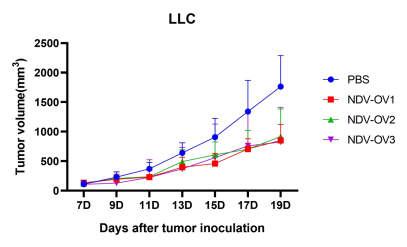
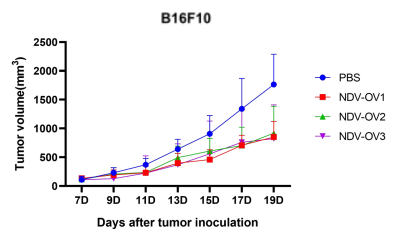
图5. 以NDV为载体的改造溶瘤病毒候选株(NDV-OV1,NDV-OV2,NDV-OV3)给药后,成瘤小鼠肿瘤体积变化。A:LLC成瘤小鼠;B:B16F10成瘤小鼠。
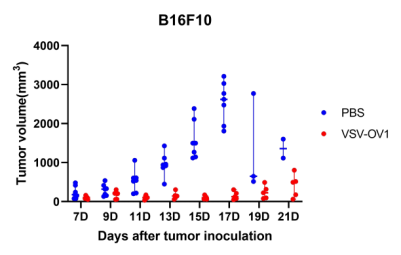
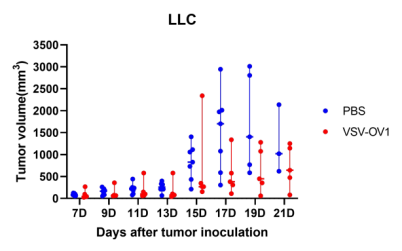
图6. 以VSV为载体的改造溶瘤病毒候选株(VSV-OV1)给药后,成瘤小鼠肿瘤体积变化。A:LLC成瘤小鼠;B:B16F10成瘤小鼠。
DIFF溶瘤病毒平台核心优势:
基于迪福润丝反向遗传操作技术平台(Viraltech Architect),可对绝大部分病毒进行基因工程改造。平台通过模块化的DCVL(Design-Construct-Verify-Learn)的方式,进行实验数据积累与更新迭代。
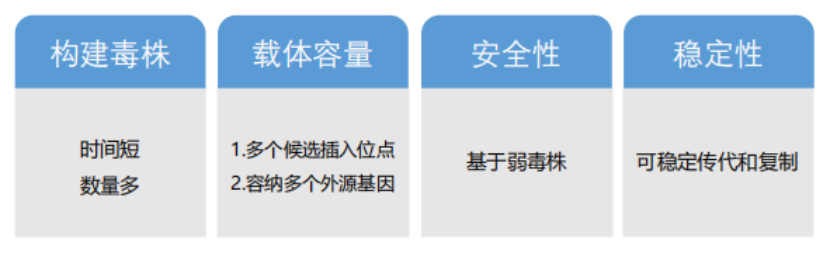
DIFF NDV载体优势:
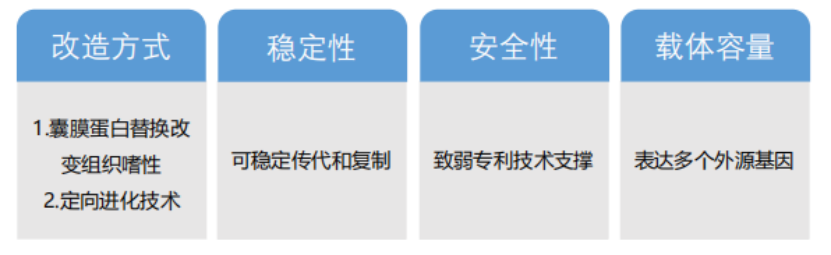
DIFF VSV载体优势:
迪福润丝生物依托全球领先的重组病毒载体技术平台,为溶瘤病毒疗法提供全流程CRO专业支持:从溶瘤病毒候选株构建(如新城疫病毒NDV、水疱性口炎病毒VSV载体等)、到动物模型药效评价以及活体成像分析。公司拥有杭州唯一一家专注于P2病毒类动物模型评价的企业实验室,加速创新疗法从实验室向临床转化,助力企业IND申报成功!
参考文献:
Liu M, Li C, Feng L T, et al. hCCL19-expressing recombinant Newcastle disease virus boosts CAR T cell infiltration and efficacy in solid tumor. Journal for ImmunoTherapy of Cancer. 2025;13:e011783
